光遗传学技术(optogenetics)与需要用到人工核酸酶(engineered nucleases)的基因组编辑技术(genome editing)这两项伟大技术的结合,为我们提供了一种用光来操控任意基因的机会。
在本期《自然》(Nature)杂志里,Konermann等人向我们展示了一种全新的技术,他们将近十年来最伟大的两项生物学技术结合到了一起,这两项技术就是光遗传学技术与基因组编辑技术。使用光遗传学技术,在靶细胞上(中)表达光敏蛋白,就可以对细胞的活动进行光调控。使用基因组编辑技术,则可以对基因组中的任意目标位点进行遗传学改造操作。将这两种技术结合在一起,就可以对基因的转录,以及基因组的修饰(genomic modifications)情况进行定向操控。
光遗传学技术可以应用于细胞和活体动物,通过使用不同颜色的光、不同强度的光和不同照射时间的光,对细胞进行非侵入性的、可逆的调控,而且这种调控还可以在时间和空间上进行高精度的掌控。到目前为止,在绝大部分光遗传学操作中使用的都还是光敏的离子通道蛋白或离子泵蛋白,通过这些蛋白来动态调节细胞的跨膜电位,尤其是引出神经元细胞的动作电位。
其实大自然中也有很多受光线调控的例子,比如植物和微生物中的光受体(photoreceptors)等等。除了少数几个特例之外,大部分光控机制都与特定的生物体有关,很难将这种光控机制移植到其它物种上。不过这些特例也表明,光遗传学机制也可以用来调控其它酶的活性,或者用于引出更加持久的细胞反应。自然界的光受体已经为科学家们提供了非常好的范例,告诉我们该如何利用已有的光反应改造生物系统。
有一种被广泛使用的策略就是利用参与了光控途径的光受体蛋白。就实际的表现、反应的强度、反应时间和易用性等几个方面考虑,对蓝光敏感的隐花色素2(cryptochrome 2)及其光反应配体蛋白CIB1是使用得最为广泛的,远胜过对红光敏感的phytochrome–PIF组合。好几个实验室已经使用光遗传学技术成功地对基因的转录过程进行了调控。最开始,科研人员们主要借助转录活化蛋白Gal4帮助光遗传学分子与DNA链上特定的靶位点结合。光照之后,就会再招募另外一个连接在Gal4蛋白活性结构域上的光遗传学分子,启动基因转录。虽然这种方法的实际效果很不错,但是由于DNA结合结构域只能与固定的几个DNA靶序列结合,而且靶基因必须以外源DNA模板的方式被插入细胞基因组当中,所以限制了这种技术的广泛应用。
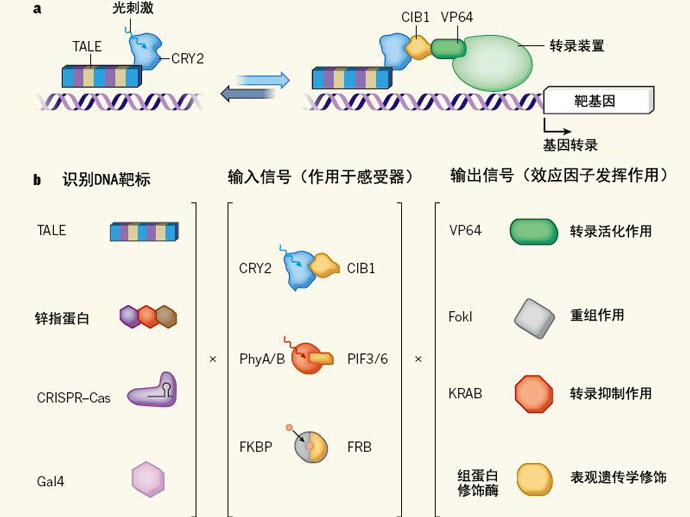
图1 对基因组功能的模块化调控机制。a,Konermann等人开发的LITE系统使用了能够与特定DNA序列结合的TALE蛋白和对光敏感的CRY2系统。在光刺激之下,CRY2蛋白与其配体蛋白CIB1结合,引发了一系列下游反应,而且这种反应还是可逆的。比如在CIB1上结合转录活化因子VP64就可以招募胞内的转录装置,启动靶基因的转录。b,这套系统的应用范围非常广泛,因为可以在其中装载各种不同的配体蛋白和效应因子。我们可以使用Gal4、锌指蛋白或CRISPR–Cas系统来识别DNA靶位点。可以使用对不同光线敏感的蛋白及其配体,比如PhyA/B和PIF3/6,或FKBP–FRB等,作为光感受器。也可以使用重组酶FokI、转录抑制因子KRAB或组蛋白修饰酶作为效应因子。
伴随着光遗传学技术的发展,又出现了一门新兴的DNA工程学技术,这种新技术可以在数十亿个碱基对组成的基因组中进行精确的定位,并进行遗传学改造,这就是所谓的基因组编辑技术。最初的基因组编辑技术主要使用的是锌指核酸酶(zinc-finger protein)和TALE核酸酶,这些蛋白都可以在基因组的特定位点进行切割,使基因被破坏,或者利用DNA损伤修复机制在该位点插入新的外源基因。不过针对特定的位点人工合成锌指蛋白或TALE蛋白可不容易,需要耗费大量的劳动力和时间。
最近新出现的CRISPR–Cas技术就很好地解决了这个费时费力的问题。利用CRISPR–Cas技术,可以在一段能够特异性识别靶序列的向导RNA分子(sequence-specific guide RNA)的引领下,将核酸内切酶带领到靶位点处,完成基因组改造的工作,如果需要对另外一个位点进行操作,只需要再合成一段新的向导RNA就够了,而我们都知道,涉及合成一段RNA分子可是要比设计合成一个蛋白质容易得多。所以CRISPR–Cas技术一出现,立刻就呈现出彻底取代锌指核酸酶和TALE核酸酶的趋势,能够以更快的速度、更低的价格、更高的效率帮助生物学家们对各种基因组进行遗传学改造。
Konermann的科研团队在光遗传学和基因组工程学领域都颇有造诣,所以他们设计了一种光诱导的转录效应因子系统(light-inducible transcriptional effector system),简称LITE系统,如图1a所示。这套LITE系统很好地解决了早期光激活转录技术(light-activated transcription-modulation approaches)对靶序列高度选择的问题。这套LITE系统由一个TALE蛋白、一个隐花色素2蛋白、一个耦联了转录活化因子VP64蛋白的CIB1蛋白共同组成。经过这样一套组合,当细胞在被蓝光照射之后,胞内的转录装置就会被TALE蛋白复合体招募到基因组特定的位点上,启动下游基因的转录和表达。通过体外试验发现,在蓝光照射之后,靶基因的表达水平可以上调10至20倍。之后Konermann等人又继续对小鼠的神经元细胞,和活体小鼠的大脑进行了试验,结果发现这套系统同样有效,能够明显上调Grm2基因和Neurog2基因的转录水平。
LITE技术有以下几个特点。首先,隐花色素2蛋白里的光反应模块是黄素腺嘌呤二核苷酸生色基团(chromophores flavin-adenine dinucleotide)和甲基四氢叶酸基团(methyltetrahydrofolate),这些分子都是普遍存在的。其次,在光照后数分钟内就可以启动基因转录,速度非常快。第三点,我们可以通过控制光照的强度来控制基因的转录水平,而且这种控制作用是可逆的,只要撤去光照刺激就可以使转录作用停止。综上所述,由于光照刺激是一种非侵入性的操控方式,所以这种LITE技术和传统的光遗传学技术一样,不仅可以用于体外培养的细胞,同样也可以用于活体动物。
如图1b所示,这套LITE系统最大的优势就在于模块式设计。由于各个模块都是“可拆卸”、可替换的,所以能够发挥各种各样的功能,比如使用不同的光感受器就可以用不同波长的光线进行控制,使用不同的效应因子则可以发挥不同的调控功效。Konermann等人就用试验数据向我们展示了不同效应因子的作用,他们给LITE系统装上了多种组蛋白修饰因子。试验证实,这套系统既可以对组蛋白进行甲基化修饰,也可以进行乙酰化修饰(这两种修饰都属于表观遗传学修饰,能够调控基因转录的速率)。可以毫不夸张地说,LITE技术进一步拓宽了光遗传学的技术的应用范围。
同样的,LITE系统里的TALE模块一样可以被替换成其它DNA结合模块,比如Konermann等人在实验中已经成功运用过的CRISPR–Cas系统。由于CRISPR–Cas系统能够非常迅速地与各种不同的基因组位点结合,所以可以让科研人员对LITE系统进行更加快速和精确的操控。将CRISPR–Cas系统与LITE系统结合能够真正地将我们带入系统生物学研究的新时代,可以以极高的序列特异性、精确的空间分辨率和完全可逆的方式,从基因组的水平上对基因表达和表观遗传学修饰进行调控。
和任何新兴的技术一样,LITE系统同样也有进一步提高的空间。尤其是在如何提高LITE系统的转录增强活性方面。LITE系统在基因组中如何定位才能最大限度地发挥调控功效也是一个值得深入研究的问题,不过有了CRISPR–Cas系统,相信这个问题很快就能够得到解决。即使以目前为数不多的试验结果来看,LITE系统也是一种非常不错的光控基因组编辑技术。由于LITE系统具有通用性、易用性、功效强以及未来的自动化潜力,所以这项技术一定会得到广泛的应用,迅速进入生物学研究的各个领域。